〈工業技術與資訊〉臺灣首座生醫跨域整合場域誕生
撰文/陳怡如
研究機構 Frost&Sullivan 預測,數位健康市場至 2023 年將達 2,200 億美元,智慧醫院相關科技呈現爆炸成長。為迎接龐大商機,首座「TIBIC 生醫產業跨域整合實驗場域」日前開幕,以三大實驗室與四大模擬臨床場域,建立國際化的醫療與科技跨領域對話交流平台,讓高階醫材研發更接地氣、產業化時程更快速。
「生醫產業跨域整合實驗場域」(Taiwan Integrated Biomedical Industrial Center;TIBIC)是臺灣第一個智慧醫療跨域整合實驗場域,吸引國際知名製藥大廠阿斯特捷利康(AstraZeneca)率先投入,成立「未來醫療實驗室」,將成為推動醫材、新藥研發及數位醫療的一大助力。
「臺灣正站在下一個生醫科技發展的轉捩點!」經濟部技術處處長邱求慧表示,生醫產業為政府六大核心戰略產業之一,經濟部歷時兩年打造 TIBIC,盼能連結法人研發能量協助智慧醫療產業,攜手醫材、資通訊業者、醫院、學校、國際合作夥伴、創投,打造完整的醫材生態系。
TIBIC 涵蓋人機互動可用性實驗室、智慧手術機器人實驗室、未來醫療實驗室三大實驗室,及模擬斷層掃描室、模擬普通病房、模擬手術室、模擬加護病房四大模擬臨床場域,工研院也有多項創新醫材在場域中驗證展示。
醫療導航系統加機械手臂 指引精準手術
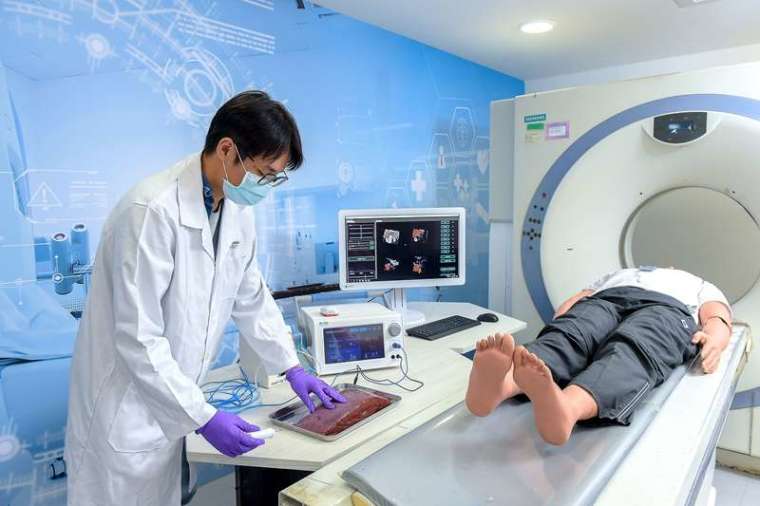
神經外科、腦部與脊椎手術最重要的是精準,手術的誤差需嚴格控制在 2 公厘內,否則可能會傷及周遭神經和血管,嚴重時甚至會造成癱瘓或神經損傷等後遺症。這類手術極度仰賴醫師經驗,工研院整合醫療導航系統與機械手臂,在病患身上貼光球,反射紅外線量測距離,醫療導航系統就能精準定位植入物的角度和深度,再透過醫療機械手臂導引,協助醫師精準執行手術,減少誤差。
實驗室模擬手術房情境,也將協助醫療器材廠商,從設計開發、系統整合再到測試驗證等一站式開發過程。工研院可提供廠商缺少的設備,並協助系統整合,實驗室也建置符合國際標準的測試方法,讓設備誤差控制在範圍之內,同時也提供模型,或是醫療測試需要的假體、手術器械,滿足廠商完整需求。

量化互動過程 縮短醫材上市時程
醫材廠商開發產品時,常需要臨床醫師即時反饋意見,驗證器材的可用性與安全性。傳統作法是請醫師實際使用,透過質性觀察與紀錄的方式提出建議,如此不僅缺少客觀的量化數據,回饋過程也不夠即時,常常導致醫材產品上市時程延遲。
在人機互動可用性實驗室中,連結醫院資源,打造符合臨床醫師手術或治療的空間,讓醫師在擬真場域中實際操作醫材。廠商可以在醫師身上貼上光球,感測紅外線反射計算距離,透過實驗中的 8 台攝影機,捕捉操作過程中每一個關節的動作、角度和速度,再搭配肌電訊號紀錄肌肉施力資訊。如此完整的量化數據,可提供廠商更即時的回饋,以便調整修正,未來還可協助中高階醫材申請上市許可時,檢附可用性評估報告,縮短醫材研發與上市時程。
腫瘤射頻熱消融技術 一針斃「病」
肝癌在臺灣十大癌症死亡率中名列前茅,過去醫師在做肝腫瘤消融時,都必須為病人多次拍攝腹部斷層掃描影像,再調整入針路徑。如此反覆照射,人體就得吸收大量輻射。工研院結合 ICT 與高階影像技術開發術前導引系統,術前即可根據電腦斷層影像,建議最佳入針路徑,讓醫師更快確定入針位置,減少反覆拍攝時間,降低人體受到的輻射量。
近年微創手術因傷口小、恢復期短,成為醫材廠搶攻的藍海市場。有了術前導引,搭配「肝臟腫瘤射頻熱消融技術」,將電極針引導至病灶局部進行區域性治療,造成局部組織壞死,效果顯著且對正常組織傷害小,臨床證實治癒率與手術開刀相當,未來可應用至肺、腎腫瘤與乳癌等,還能結合機械手臂,讓手術更加精準有效率。
應用光場技術 單鏡頭也能取得 3D 影像
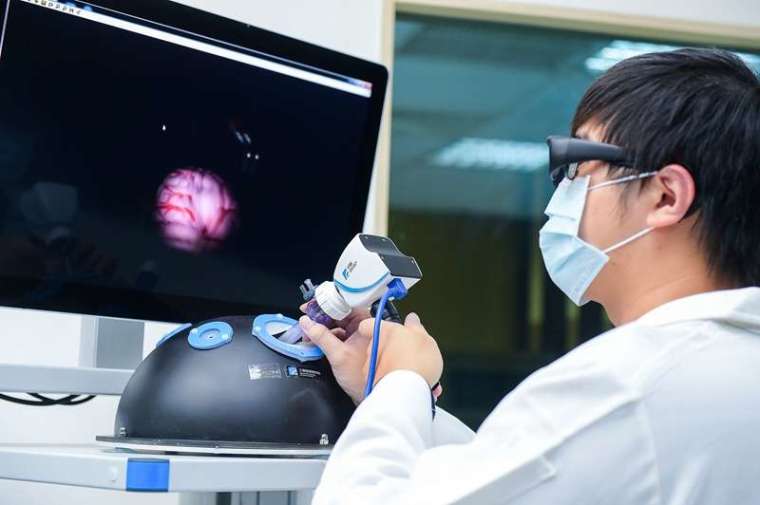
3D 內視鏡可以讓醫師獲得更立體真實的影像,減少手術時間並提升精準度,但目前 3D 內視鏡的普及率仍低,主要因為 2D 內視鏡大小約為 4 公厘,採雙鏡頭設計的 3D 內視鏡則為 10 公厘,遇到腦神經外科手術或脊椎手術,開孔只有 10 到 15 公厘左右,若用 3D 內視鏡,幾乎占滿整個工作孔道,實際使用有困難。
工研院應用光場技術,在內視鏡的鏡頭前多加一片微透鏡陣列,這是由上百個小鏡頭組成的陣列,模擬昆蟲複眼看到的影像,透過軟體運算將這些小影像中的立體資訊取出,轉成立體影像。工研院研發的「單鏡頭 3D 內視鏡取像模組」,單鏡頭就能取得整個場景的深度資訊,成功將 3D 內視鏡的體積,縮小至 2D 內視鏡的大小,未來醫師進行精細手術時,也能有 3D 影像輔助。
紅外線掃描 腸道斷層影像立刻現形
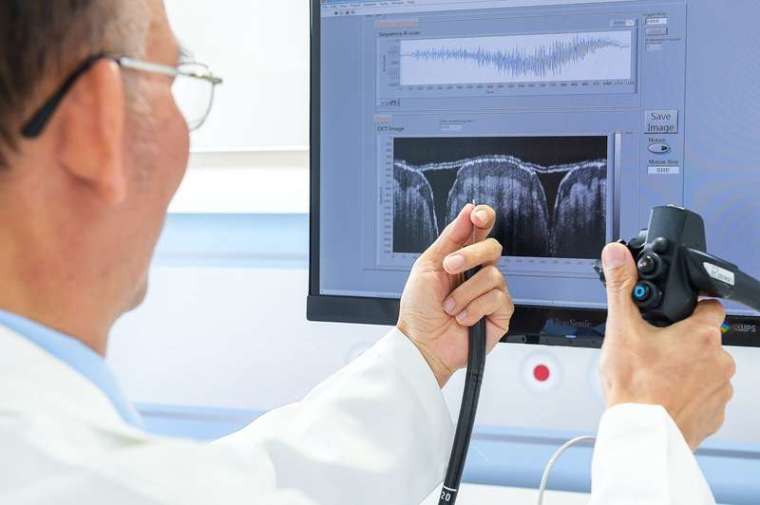
大腸癌連續 12 年高居臺灣十大癌症之首,醫界慣常以大腸息肉的侵襲程度來決定治療方式:若在 1.3 公厘內,可直接執行內視鏡黏膜下剝離術;若超過 1.3 公厘,就可能產生淋巴轉移,需進行切腸手術。目前醫師確認息肉深度的方式較屬間接,主要使用放大內視鏡,拍攝腸道表面紋路皺褶,再以紋路推估侵襲深度,容易造成誤判。
工研院研發的「OCM 內視鏡-光學式組織虛擬切片系統」,整合內視鏡、紅外線光學系統、掃描模組、影像擷取與訊號處理技術、演算法,以紅外線穿透組織結構,可即時呈現 1.6 公厘深的斷層影像,有效協助醫師進行判斷,減少非必要的手術及病理切片分析時間,未來也能應用在腦科微創、眼科視網膜、白內障手術和口腔診斷中。
轉載自《工業技術與資訊》月刊第 347 期 2020 年 12 月號,未經授權不得轉載。